Lungenembolie
Ätiologie
Ca. 90 % aller Lungenarterienembolien (LAE) sind Folge einer tiefen Beinvenenthrombose (TVT). Bei etwa 2/3 aller Patienten mit TVT lassen sich mit entsprechend sensitiven Verfahren Lungenembolien nachweisen, die weit überwiegend klinisch stumm verlaufen sind. Die LAE verläuft häufig rezidivierend und tritt beidseitig auf.
Risikofaktoren
- Genetische Disposition (20 %): Thrombophilie: Prot. C, Prot. S, AT III, Faktor V-Leiden (APC Resistenz), Antiphospholipid-Syndrom
- Nikotinabusus
- Schwangerschaft, Kontrazeptiva +/- Nikotin (7x Risiko!)
- Malignome (Pankreas, Ovarien, Niere, Magen)
- Immobilität (Economy-class Syndrom), eThrombose (iThrombose?)
- Operative Eingriffe
Klinik
Typische klinische Befunde
- Bei peripheren LAE häufig plötzlich einsetzender Husten und atemabhängige Schmerzen. Evtl. Haemoptysen. Rezidiv. (sub-)febrile Temperaturen. Selten plötzliche Luftnot, eher langsam progredient.
- Bei segmentalen LAE seltener atemabhängige Schmerzen aber vermehrt Luftnot. (Typische BGA Veränderungen). Keine Haemoptysen.
- Bei zentralen LAE häufig Synkopen, massive Luftnot, Zeichen der akuten Rechtsherzinsuffizienz/ Rechtsherzversagen. Haemodynamische Instabilität/ Schock [Schellong, 2009].
- Tachykardien bzw. (intermittierende) Tachyarrhythmien sind bei allen LAE-Lokalisationen möglich.
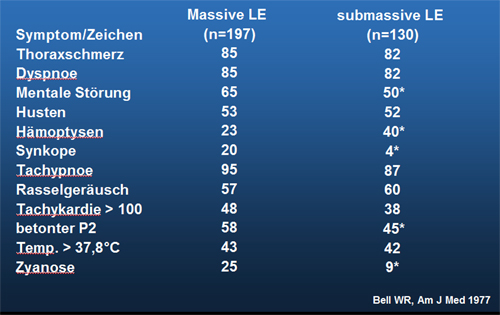
Tabelle 17.1: Klinische Symptomatik bei LAE
Schweregrade der Lungenembolie (Stadien modifiziert n. [22])
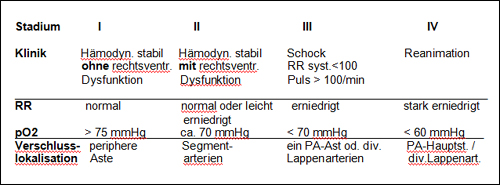
Tabelle 17.2: Einteilung der Schweregrade bei Lungenembolie
Diagnostik
Algorithmen zum diagnostischen Procedere, Score für klinische Wahrscheinlichkeit (KW) und Stadieneinteilungen
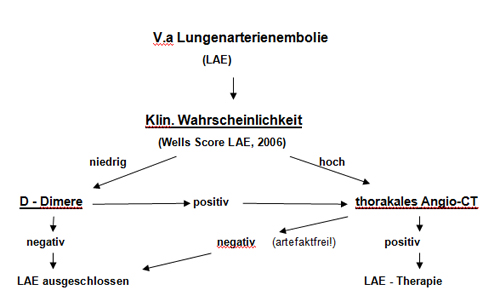
Abb. 17-1: Algorithmus zur Diagnostik der hämodynamisch stabilen LAE
[Constantinidis, 2006] (Stadium I und II)
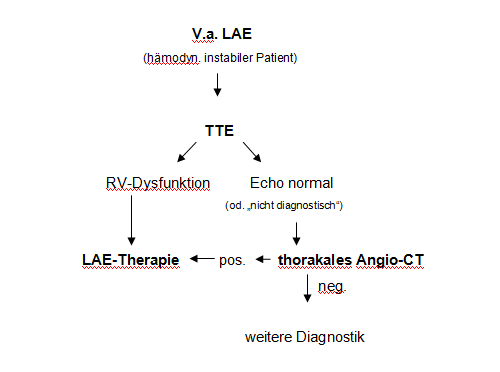
Abb. 17.2: Algorithmus zur Diagnostik der hämodynamisch instabilen LAE
[Constantinidis, 2006] (Stadium III und IV).
TTE = Transthorakale Echokardiographie, RV = rechter Ventrikel, CT = Computertomographie, KW = klinische Wahrscheinlichkeit (Vortestwahrscheinlichkeit).

Tabelle 17.3: LAE–Score nach Wells PS et al, (Ann Intern Med, 1998; modifiziert 2006).
TVT / LAE-Scores erfordern grundsätzlich mind. ein weiteres positives diagnostisches Kriterium für den Nachweis einer thromboembolischen Erkrankung.
Klinische Diagnostik
- Anamnese
- Familienanamnese (deutlich erhöhtes Patientenrisiko bei pos. Familienanamnese für VTE und/ oder idiopathische Aborte)
- Eigenanamnese (TVT? LAE? Aborte? NPL? Thrombophlebitiden? Bekannte Thrombophilie?)
- Körperliche Untersuchung
- Komplette körperliche Untersuchung incl. rektaler Untersuchung mit Haemoccult-Test. Mammatastbefund, Hodentastbefund (Tu.?).
- Bei unregelmäßiger ambulanter Vorsorge: gyn. Konsil.
Laborchemische Diagnostik
D-Dimere
Abbauprodukt des durch Faktor XIII quervernetzten Fibrins.
„Falsch“ positive Werte finden sich bei allen Tests, besonders postoperativ (14 (–60) Tage)
[Lindhoff, 2004], posttraumatisch, bei Entzündungen, bei Malignomen
[Partsch, 1996;
Interdisziplinäre S2 Leitlinien] sowie in Schwangerschaft und Wochenbett. Damit scheiden D-Dimere als eigenständiges Diagnostikum für die primäre Detektion einer thromboembolischen Erkrankung aus. Der Nachweis von erhöhten D-Dimeren allein ermöglicht somit keinerlei spezifische diagnostische Aussage
[Miesbach, 2004].
Entscheidend ist, mit welcher Sicherheit der Test zum Ausschluss einer akuten TVT/ LAE beitragen kann. Der eigentliche „Ausschluss“ muss zusammen mit negativer Vortestwahrscheinlichkeit, sowie einem negativen bildgebenden Befund im Rahmen eines gesicherten diagnostischen Algorithmus erfolgen (s. Abb. 17.1 und 2).
Kontrolle der D–Dimere ca. 1 Woche vor und ca. 4 Wochen nach Absetzen der Antikoagulation bei idiopatischer VTE empfohlen! Bei persistierend erhöhten D-Dimeren vor geplantem Absetzen, sollte eine langfristige Verlängerung der VKA- Therapie diskutiert werden. Weiterhin erhöhte Werte sind in jedem Fall abklärungsbedürftig!
Einige Autoren verlängern die Antikoagulation „unbefristet“, wenn die Dimere vor geplantem Absetzen weiter erhöht sind (u.a. R. Klamroth, 01/2011; E. Lindhoff-Last, 05/2011).
Die sonographische Bestimmung der „Restthrombuslast“ bietet ein zusätzliches prognostisches Kriterium. Vieles spricht für ein erhöhtes Rezidivrisiko, insbesondere wenn „falsch“ positive Dimer-Werte (s.o.) ausgeschlossen sind [Palareti et al., 2002; Eichinger et al., 2003].
Ein Tumorscreening oder eine Thrombophiliediagnostik sollte ggf. aktualisiert werden.
Troponin T
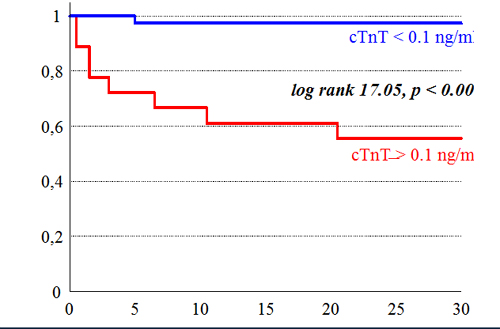
Abb. 17-3: Risikostratifizierung Troponin T
Apparative Diagnostik
- 12 Kanal Ruhe EKG
- Bis zu 50 % Normalbefunde, sonst Zeichen der Rechtsherzbelastung.
- Insbesondere neu aufgetretene Vektordrehung nach rechts.
- Kompletter od. inkompletter Rechtsschenkelblock (RSB).
- P-dextroatriale (= »P-pulmonale«).
- SI/QIII-Typ od. SI/II/III-Typ.
- Neg. T-Wellen in V2–3(–4).
- Vergleich mit Vor-EKG!
- Sinustachykardie oder TAA (> 100/min.) bes. in der Akutphase.
- Die beschriebenen Veränderungen können einzeln oder kombiniert auftreten. In keinem Fall sind sie beweisend für eine LAE!
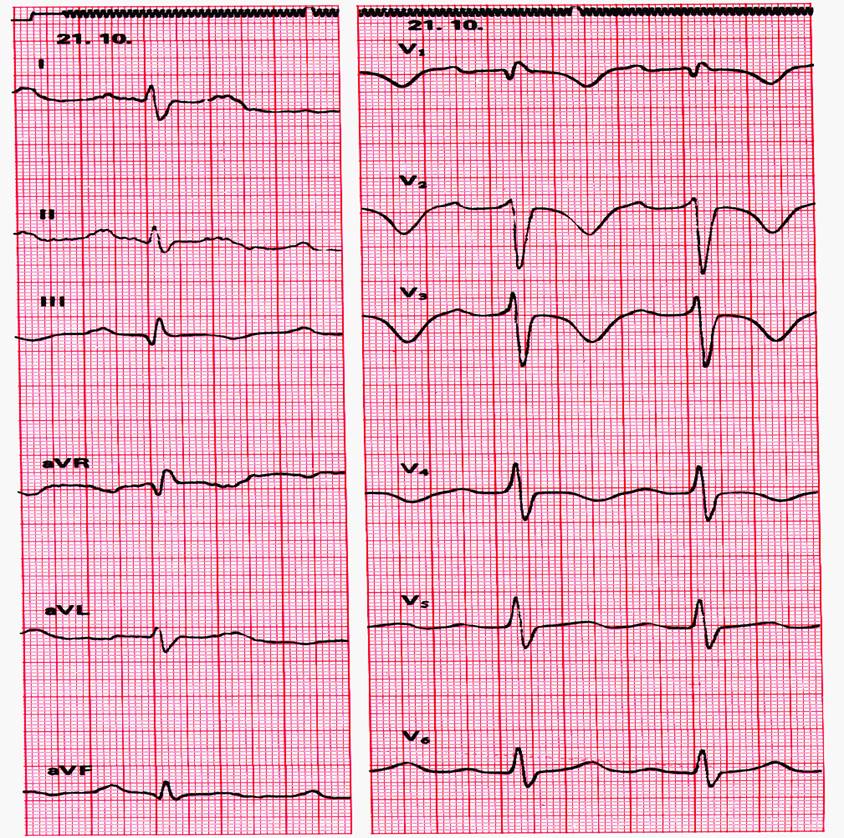
Abb. 17.4: EKG bei LAE: SIQIII Typ, terminal negatives T in V1–V4, Inkompl. RSB+
- Art. Blutgasanalyse (BGA)
- Obligat für die Ersteinschätzung und die Verlaufskontrollen bzgl. des respiratorischen und metabolischen Status des Patienten.
- Typisch Hypokapnie und Hypoxämie. Nicht geeignet zum Nachweis oder Ausschluss einer LAE!
- Cave: Eine pathologische BGA macht eine Lungenembolie nicht wahrscheinlicher, eine normale BGA schließt sie nicht aus!
- Echokardiographie
- Sensitivität ca. 80 %.
- Zeichen der neu aufgetretenen Rechtsherzbelastung sind richtungsweisend für die Fragestellung nach evtl. ambulanter Weiterbehandlungsmöglichkeit, bestimmen die Prognose und sind hilfreich für die Entscheidung für oder gegen eine Fibrinolysetherapie im Stad. (II-) III.
- Die Mortalität ist signifikant erhöht, wenn eine Rechtsherzinsuffizienz nachgewiesen wird.
- Nachweis von mobilen Thromben im rechten Herzen prognostisch ungünstig (Letalität 35 %).
- Normalbefund spricht gegen hämodynamisch relevante LAE, schließt kleinere LAE aber nicht aus.
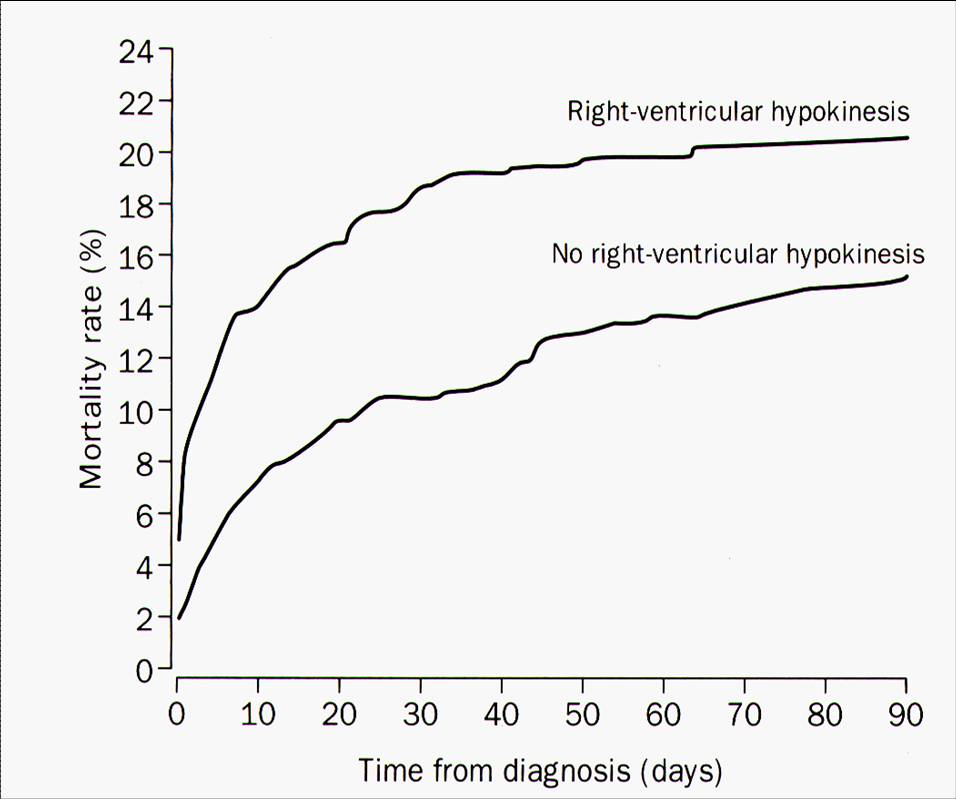
Abb. 17-5: Risikostratifizierung Echokardiographie. Die Mortalität ist signifikant erhöht, wenn eine Rechtsherzinsuffizienz nachgewiesen wird.
- Thoraxsonographie
- Transthorakal: Nachweis peripherer infarzierter Areale. Darstellung auch kleinerer Pleuraergüsse als mögl. Sekundärzeichen. Diagnostischer Baustein u.a. bei Gravidität.
- Endobronchialer Ultraschall (EBUS): Nachweis zentraler Lungenembolien. Potentielle Alternative zum thorakalen AngioCT (CTPA), auch bei Gravidität oder bei KM-Allergie.
Kompressionsphlebosonographie (KUS)
Bei hochgradigem klinischen V.a. hämodynamisch stabile LAE gilt der phlebosonographische Nachweis einer TVT als Diagnosesicherung für die LAE
[Interdisziplinäre S2 Leitlinien, Diagnostik und Therapie der Venenthrombose und der Lungenembolie 2015 (AWMF >>)].
- Primär zur Abklärung der Differentialdiagnosen: Pneumonie, Pneumothorax, Lungenödem
- Normalbefund eher typisch bei LAE!
- Spezifisch aber selten: Gefäßabbrüche (Westermark-Zeichen).
- Sekundäre LAE-Zeichen: Pleuraerguss.
- Einseitiger Zwerchfellhochstand. Plattenatelektasen, bevorzugt beidseits.
- Periphere keilförmige Infiltrate, bei z.B. Infarktpneumonie.
Lungenszintigraphie
CT–Pulmonalisangiogramm (CTPA). Synonym: thorakales Angio-CT
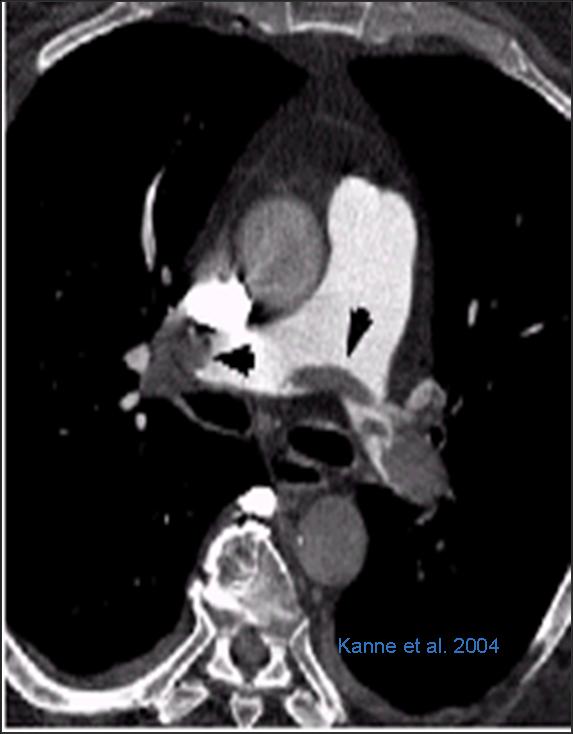
- Sicherer Nachweis zentraler und peripherer LAE mit Geräten >16 Zeilen, Schichtdicke 0,75mm.
- Bei Schwangeren mit hochgradigem V.a. LAE im Stad. III / IV, letztlich aber doch unklarem Befund ist das TCT für den Fötus schonender als eine Szintigraphie [Schellong, 2009].
- Ein technisch einwandfreies (!) negatives CT-Pulmonalisangiogramm entspricht dem Ausschluss einer LAE [Miesbach, Scharrer, 2004 - PubMed 15543473].
- Beachten: hohe Strahlenbelastung und potentiell nephrotoxisches KM.
- Diagnose von Lungenembolie und TVT (bis > V. poplitea) innerhalb eines Untersuchungsganges generell möglich, dabei aber noch höhere Strahlenbelastung [Loud et al., 2001]; [Interdisziplinäre S2 Leitlinien, Diagnostik und Therapie der Venenthrombose und der Lungenembolie 2015 (AWMF >>)].
- Kein Routineverfahren.
Pulmonalisangiographie
Ehemaliges diagnostisches Referenzverfahren, jetzt meist nur noch für ausgewählte instabile Patienten als interventionelle gefäßrekanalisierende Prozedur bei erfolgloser oder kontraindizierter Lyse.
Spezielle laborchemische Diagnostik
Thrombophiliediagnostik
- Faktor-V-Leiden Mutatation (APC–Resistenz)
- Prothrombinmutation
- Antiphospholipid–Syndrom
- D-Dimere
- Protein S
- Protein C
- Antithrombin III
- Fibrinogen.
- Bei jungen Pat. zusätzlich:
- Faktor VIII:C,
- Homozystein / MTHFR (umstritten).
Tipp: Patienten mit relevantem (!) pathologischem Thrombophilielabor profitieren von einer Befundkopie in Brief- oder Handtasche.
Faktor-V-Leiden Mutation
Eine Faktor-V-Leiden Mutation (G 16911A) führt dazu, dass das APC-System seine hemmende Aktivität verliert und sich dadurch das Risiko thromboembolischer Komplikationen erhöht. Mit einer Prävalenz von ca. 5 % in der Bevölkerung ist sie die häufigste Genmutation mit allerdings deutlichen ethnischen Unterschieden. Die höchsten Prävalenzen werden bei Skandinaviern gesehen.
Das relative Risiko bei heterozygoten Mutationsträgern erhöht sich gegenüber nicht Betroffenen wahrscheinlich nicht signifikant, nach Meinung anderer Autoren um das ca. 8fache. Sicher erhöht ist es jedoch nach einer ersten stattgehabten VTE. Bei der homozygoten Mutation erhöht sich das Risiko um das ca. 50–80fache. Heterozygote Frauen, die Kontrazeptiva einnehmen, haben ein ca. 30–35fach erhöhtes, homozygote Frauen unter Hormontherapie ein etwa 200fach erhöhtes Risiko.
APC-Resistenz (APC)
Häufigste Ursachen aller vererbten Thrombophilien. Resistenz des Faktor-V gegenüber aktiviertem Protein C ausgedrückt durch einen Quotienten. Bei Faktor < 2,0 sicher pathologisch. Bei Faktor > 3,0 Normalbefund. Bei pathologischem Wert ist eine weitere Sicherung durch molekulargenetische Untersuchungen empfohlen. Betroffen sind in Mitteleuropa ca. 5 % der gesunden Bevölkerung. Nur wenige von ihnen erkranken an einer Thrombose, solange keine weiteren Risikofaktoren hinzutreten!
Thrombosepatienten haben dagegen in 20 (bis 40 %) der Fälle eine patholog. APC-Resistenz. Kein relevantes Vorkommen bei Afrikanern und Asiaten. Pathologische APC-Resistenz führt überwiegend zu Thrombosen, aber auch zu arteriellen Verschlüssen. Eine APC-Resistenz wird in ca. 95 % der Fälle durch eine Faktor-V-Leiden Mutation verursacht. Aus praktischen und ökonomischen Überlegungen könnte deshalb auch auf die Bestimmung der APC-R verzichtet und direkt die molekulargenetische Faktor V-Untersuchung durchgeführt werden.
Prothrombin (Faktor II)-Mutation
Zweithäufigste Ursache aller vererbten Thrombophilien.
Vorkommen bei ca. 7–16 % der Thrombosepatienten, gehäuft in Verbindung mit pathologischer APC-Resistenz.
Eine Mutation im Faktor II Gen (G 20210 A) führt zu einem vermehrten Aufkommen von Prothrombin. Eine Prothrombinmutation allein erhöht das Thromboserisiko nur geringfügig. Die Bedeutung steigt erst durch das Zusammentreffen mit weiteren Risikofaktoren, z.B. der Einnahme von Ovulationshemmern [ Willeke, 2002]. Neben dem venösen Thromboserisiko wird ein zusätzliches Risiko für arterielle Verschlüsse diskutiert. Afrikaner und Asiaten sind von der Prothrombinmutation nur selten betroffen [Seligsohn, 2001].
Protein C-, Protein S-Mangel
Gerinnungshemmende Faktoren, deren Synthese in der Leber Vitamin K-abhängig ist. Mangel bei ca. 2–5 % der Thrombosepatienten.
- Angeborener Mangel: Thromboembolien oft schon im Kindesalter
- Erworbener Mangel: Synthesestörungen (Leber, erhöhter Verbrauch (Verbrauchskoagulopathie), Vitamin K-Mangel / Cumarintherapie
Methylen-tetrahydrofolat Reduktase (MTHFR-) Mutation, Homozystein
Die Methylen-tetrahydrofolat Reduktase (MTHFR) ist ein Schlüsselenzym im Homozysteinstoffwechsel. Eine Mutation führt zu einer thermolabilen Variante mit verminderter Aktivität und in der Folge erhöhten Homozysteinspiegeln. Dies ist ein eigenständiger, in der erworbenen Form zwar leicht therapierbarer (Gabe von Vit. B6 und B12), aber in seiner pathogenen Bedeutung nicht klar einzuordnender Risikofaktor für AVK / KHK.
Antithrombin III (AT III–Mangel)
Betroffen sind ca. 2–4 % der Thrombosepatienten.
- angeborene Varianten: Typ I = AT III-Mangel, Typ II = AT III-Defekt
- erworbene Varianten: verminderte Synthese (Leber), erhöhter Verbrauch (Schock, DIC), erhöhter Verlust (nephrotisches Syndrom).
Bei Abnahme beachten: Citratröhrchen. Bestimmung im Rahmen der Laborroutine möglich. Ggf. nach TVT- Diagnosestellung nachfordern. Häufig niedrige Werte bei frischer TVT u./od. unter Heparintherapie. Keine signifikante Veränderung unter Cumarintherapie zu erwarten. Erneute Bestimmung 1–2 Monate nach Absetzen der Antikoagulation sinnvoll.
Antiphospholipid-Syndrom (APS)
Systemische Autoimmunerkrankung. Häufig. W : M = 3–5 : 1. Bei ca. 2–5 % der Bevölkerung gelingt der Nachweis von Antiphospholipid-Antikörpern (APA). Nur sehr wenige dieser Menschen entwickeln ein APS. Andererseits lassen sich APA bei bis zu 14 % der VTE-Patienten bestimmen.
- Primäres APS (PAPS) ca. 50 % d.F.: Kein Nachweis einer zugrunde liegenden Erkrankung. Bis zu 20 % aller PAPS–Patienten leiden unter Migräne bzw. Raynaud–Syndrom.
- Sekundäres APS (SAPS) ca. 30 % d.F.: Häufig bei Kollagenosen (meist SLE), seltener bei Malignomen (u.a. NHL, Plasmozytom), Infektionen (u.a. HIV, Hepatitis) oder als unerwünschte Arzneimittelwirkung (u.a. Chinidin, Phenytoin).
Klinik
- venöse Thromboembolien (oft »ungewöhnliche« Lokalisation). TVT / LAE, Sinusvenenthrombosen oder Thrombosen der Zentralvenen des Auges. Mikroangiopathische Thromben.
- Auch chronische Ulcera oder andere Hautmanifestationen, wie z.B. Livedo reticularis.
- Arterielle Thromboembolien
- Spontanaborte, rezidiv. Frühgeburten
- Insult / TIA, zerebrale Krampfanfälle
- KHK / Myokardinfarkt, andere Organinfarkte
- Thrombozytopenie (meist < 50.000), Hämolyse, paradoxe Blutung (selten).
Diagnose des Antiphospholipid-Syndroms / Sapporo Kriterien
[Wilson, 1999; Bauersachs, 2004; Bergmann, 2008]
Klinische Kriterien
- Thromboembolien: Eine oder mehrere venöse oder arterielle Thrombosen.
- Schwangerschaftskomplikationen
- Mind. drei Aborte nach der 10. SS-Woche (SSW) bei gesundem Fötus.
- Mind. eine Frühgeburt bei gesundem Fötus vor der 34. SSW aufgrund (Prä-)Eklampsie oder Plazentainsuffizienz.
- Mind. drei Spontanaborte vor der 10. SSW unter Ausschluss anatomischer, endokrinologischer Ursachen bzw. chromosomaler Erkrankungen der Eltern.
Serologische Kriterien (2x pos. Nachweis im Abstand v. jew. mind. 12 Wochen)
- Lupus-Antikoagulans (LA), z.B. LAC-Screen Test (DRVVT), MIX CON LA.
- Anticardiolipin–Antikörper (IgG- u. IgM).
- Anti-ß2-Glykoprotein 1-AK.
Das APS ist gesichert, wenn mindestens ein klinisches und ein serologisches Kriterium nachgewiesen sind. Der Nachweis von Antiphospholipidantikörpern allein bedeutet nicht zwingend eine thrombophile Diathese.
Faktor VIII [Willeke, 2002]
Unabhängiger Risikofaktor sowohl für venöse, als auch für art. Thromboembolien. Erhöhte Werte bei frischer TVT häufig. Bei Persistenz (> 150 % des Normalbereiches) über zwei Monate nach dem Akutereignis muß von einem pathologischen Befund und damit von einem ca. fünffach erhöhten TVT-Risiko ausgegangen werden. Bei dauerhaft signifikant erhöhten Faktor VIII-Werten sollte eine prolongierte Antikoagulation angestrebt werden [Bastian, 2000]
Faktor VIII ist ein akute Phase Protein. Bei erhöhtem CRP ist eine Bestimmung nicht sinnvoll.
Bei Abnahme beachten: Einmaliger Nachweis nicht ausreichend. Bestimmung zwei Monate nach dem Akutereignis und einen Monat nach Absetzen der Antikoagulation.
Seltenere Thrombophilie-Parameter (Auswahl)
- Erhöhte Aktivität des Plasminogen-Aktivator-Inhibitors I (PAI I)
- erhöhter Plasmafibrinogen-Spiegel
- angeboren (selten)
- erworben / passager (häufiger) - Faktor XII-Mangel (Hagemann Faktor), VTE u./od. art. Thromboembolien
- Plasminogenmangel.
Hinweis: Bei rezidivierender idiopathischer VTE schließt ein fehlender benennbarer Thrombophilie-Faktor keine Thrombophilie aus. Zum einen »demaskieren« sich einige Parameter erst im Laufe der Zeit, zum anderen sind erfahrungsgemäß einige Faktoren noch gar nicht entdeckt. Wie auch immer: Patienten mit rezidiv. idiopathischen VTE sollten längerfristig antikoaguliert werden.
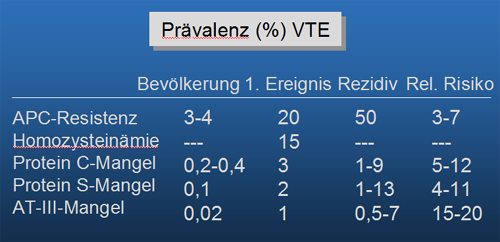
Tabelle 17.4: Thrombophilie Prävalenz (%) VTE
Therapie
Medikamentöse Therapie
Initial bevorzugt NMH oder Fondaparinux. Nachbehandlung mit Marcumar® (Kontraindikationen beachten), alternativ Rivaroxaban®. Bei KI alternativ dauerhaft systemische Gabe eines NMH oder Fondaparinux.
Die therapeutische Antikoagulation soll sofort begonnen werden, bevorzugt mit niedermolekularem Heparin oder Fondaparinux (Tabelle 17.6)
![]()
Tab. 17.6 Initiale Antikoagulation bei Venenthrombose oder Lungenemebolie (Stand: Juni 2010)
| Wirkstoff | Präparat | Hersteller | Dosierung (s.c.) |
Zeit- inter- vall |
|
NM-Heparine
|
||||
| Certoparin |
Mono-Embolex® 8000 IE Therapie |
Novartis |
8000 IE |
2x tgl |
| Dalteparin |
Fragmin® |
Pfizer |
100 IE/kg KG S200 IE/kg KG |
2x tgl 1x tgl |
| Enoxaparin |
Clexane® |
Sanofi- Aventis |
1,0 mg/kg KG |
2x tgl |
| Nadroparin |
Fraxiparine® Fraxodi® |
GlaxoSmith Kline (gsk) |
0,1 ml/10 kg KG 0,1 ml/10 kg KG |
2x tgl 1x tgl |
| Reviparin |
Clivarin® Clivarodi® |
Abott Abott |
0,5/0,6 oder 0,9 ml nach KG 0,6 ml bei KG >60 kg |
2x tgl 1x tgl |
| Tinzaparin | innohep® | LEO Pharma | 175 IE/kg KG | 1x tgl |
|
Pentasaccharid
|
||||
| Fondaparinux |
Arixtra® |
GlaxoSmith Kline (gsk) |
7,5 mg KG <50 kg: 5 mg KG >100 kg: 10 mg |
1x tgl 1x tgl 1x tgl |
![]()
- Von einer verlängerten Antikoagulation profitieren:
- Männer
- > 65 LJ
- Proximale TVT
- Symptomatische LE
- Schweres postthrombotisches Syndrom
- Positiver D-Dimertest nach 6 Monaten Antikoagulation.
LMWH versus unfraktioniertes Heparin bei TVT
Metaanalyse
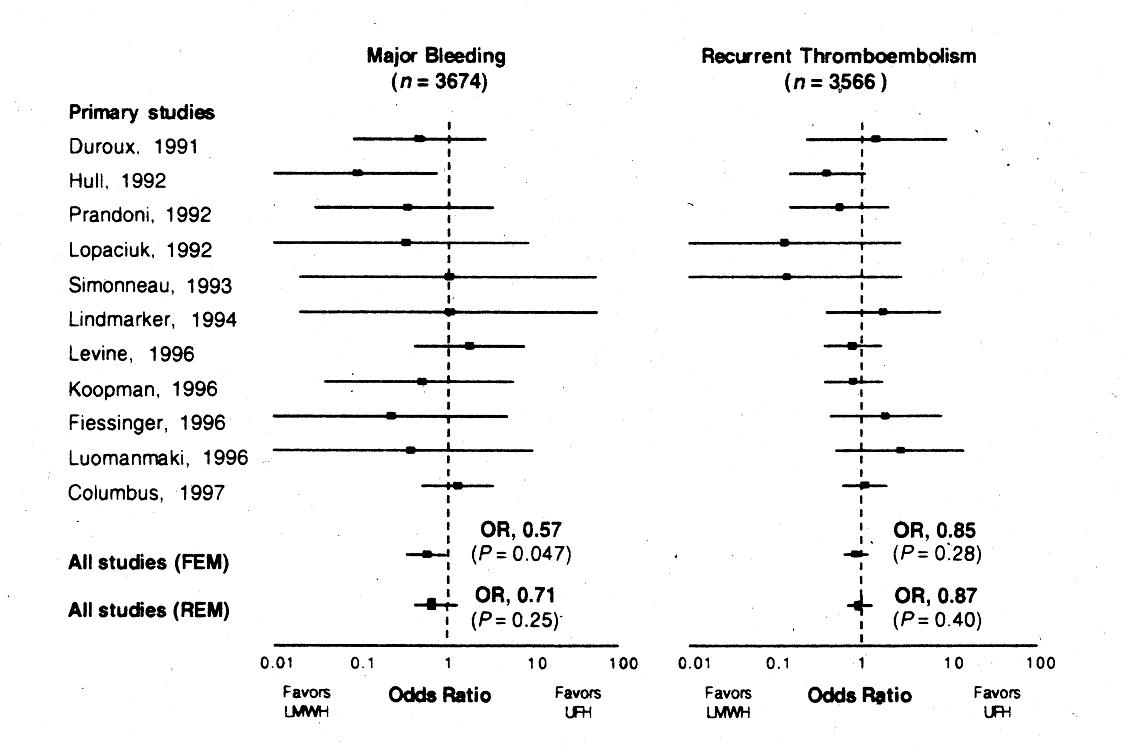
Abb. 16-2: LMWH versus unfraktioniertes Heparin bei TVT (Gould et al, Ann Intern Med 1999).
LMWH versus unfraktioniertes Heparin bei TVT: Signifikante Mortalitätsverbesserung durch niedermolekulares Heparin.
Metaanalyse
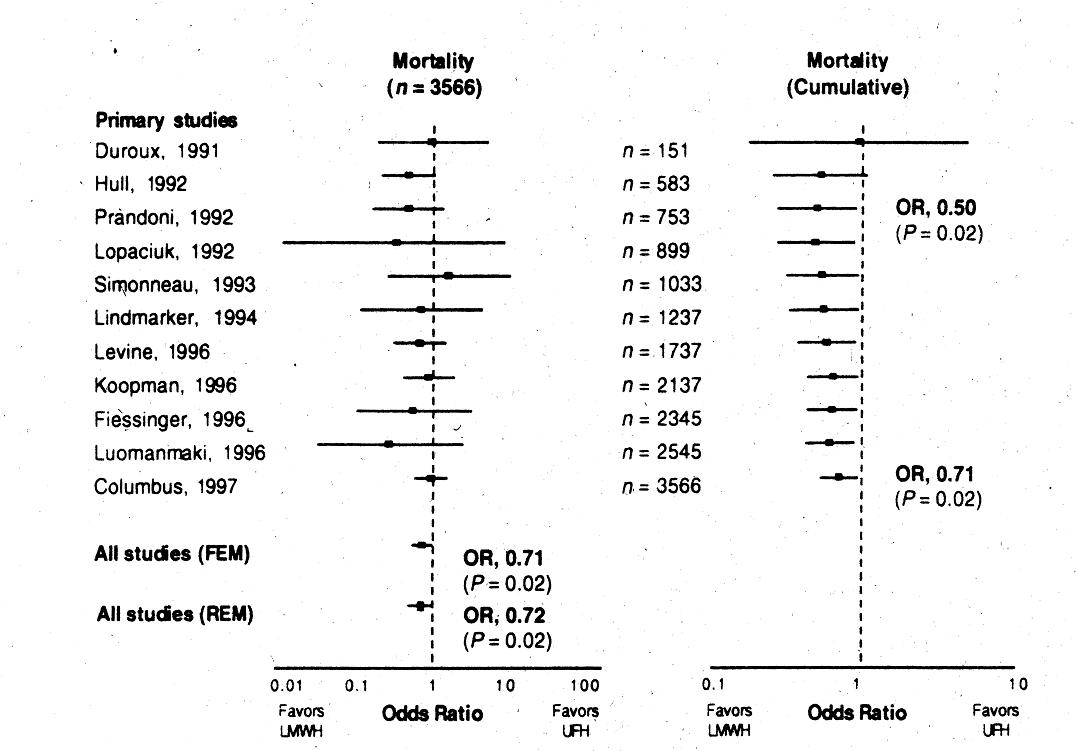
Abb. 16-3: LMWH versus unfraktioniertes Heparin bei TVT (Gould et al, Ann Intern Med 1999).
Thrombolysetherapie
- Indikation: Stadium III und IV nach Grosser bzw. massive Lungenembolie. Da die massive Lungenembolie lebensbedrohlich ist, sind die KI für eine Lysetherapie zu relativieren: Nur relative KI für eine Lysetherapie im Stadium IV bei lebensbedrohlichem Schock. Alternativ Notfallembolektomie nach Trendelenburg in einer thoraxchirurgischen Abteilung (selten indiziert). Auch Malignompatienten (hohes Thrombose- und Embolierisiko) können von einer Lysetherapie profitieren.
- Durchführung:
- Alteplase: 100 mg über 2 h i.v. immer gleichzeitige Vollheparinisierung.
- Urokinase: 1 Mio. IE initial als Bolus über 10 Min. i.v., dann 1–2 Mio. IE/h über 1–2 h. Bei vitaler Ind. evtl. 2 Mio. IE i.v. als Bolus, immer gleichzeitige Vollheparinisierung, ggf. auch unter Reanimationsbedingungen.
- Streptokinase: 1,5 Mio. IE in 30 Min. über Perfusor, dann 1,5 Mio. IE über 2 h, danach Vollheparinisierung.
- Bei Indikationsstellung für Lysether. eine lysepflichtige Phlebothrombose nicht übersehen, jedoch Indikation für Lyse bei Phlebothrombose sehr selten!
Thrombolyse-Schema bei massiver Lungenembolie

Tabelle 17-5: Thrombolyse-Schema bei massiver Lungenembolie
Heparininduzierte Thrombozytopenie
HIT II-Diagnostik (HIT = heparininduzierte Thrombozytopenie)
- Screening: Regelmäßige Thrombozyten-Kontrollen unter UFH-Therapie an den Behandlungstagen 4–15 (2 x pro Wo., z.B. Mo., Do.).
- Aber Vorsicht bes. bei multimorbiden Patienten und unklarer Anamnese (HIT II?) in den ersten 12 potentiellen Reexpositionswochen, z.B. nach möglicher vorheriger Krankenhausbehandlung. Hier sind Thrombozytenkontrollen auch an Tag 1, 3 und 5 indiziert.
- Nicht operierte internistische Pat., die mit NMH behandelt werden, haben ein HIT II Risiko von < 0,1 %. Sie benötigen keine engmaschige Kontrollen
[Willeke, 2010].
Lungenembolie in Schwangerschaft, Wochenbett und Stillzeit
Die Lungenembolie ist eine der häufigsten Todesursachen in Schwangerschaft und Wochenbett.
Therapie
- UFH ist das einzige zugelassene Mittel in der Schwangerschaft und Stillzeit bei notwendiger Antikoagulation der Mutter [Kleinebrecht, 1999].
- Vitamin K-Antagonisten (VKA) sind sowohl im ersten als auch im letzten Trimenon mit erheblichem Gefährdungspotential für den Feten / Embryo verbunden.
- In der Stillzeit sind sie jedoch unproblematisch sofern die notwendigen Vit. K-Prophylaxe für den Säugling beachtet wird.
- Mittel der Wahl in der Schwangerschaft: niedermolekulares Heparin (Cave: keine Zulassung!).
- Entsprechende Aufklärung unverzichtbar!
- Osteoporoseprophylaxe bei NMH beachten.
- Beginn an Tag 1 bei vorhersehbarer Therapiedauer > 5 Tage! (umstritten)
- Die Anti Xa-Aktivität sollte besonders im letzten Trimenon regelmäßig kontrolliert werden. Diskutiert wird die Halbierung der therapeutischen Dosis unter Anti Xa-Kontrollen nach einem Zeitintervall von 10 Tagen bis 4 Wochen mit voller Dosierung.
- Keine Dosisreduktion bei Herzklappenpatientinnen.
- Letzte NMH Gabe 12 h vor Entbindung anstreben. Nach Geburt Antikoagulation in therapeutischer Dosierung bis mind. 6. Woche postpartal.
- Bei Schwangeren mit Heparinunverträglichkeit/ HIT II ist Danaparoid (Orgaran) Mittel der Wahl. Cave: Kreuzunverträglichkeit in bis zu 18 % d.F.
- Nach einer ersten Schwangerschaftsthrombose ohne erkennbare weitere Risikofaktoren ist eine
Thrombophiliediagnostik indiziert. Sollte eine Thrombophilie diagnostiziert werden, besteht potentiell ein erhöhtes Rezidivrisiko bei weiteren Schwangerschaften und eine Indikation zu einer entsprechenden medikamentösen Prophylaxe. Ohne Thrombophilie ist das Risiko einer Rezidivthrombose nach einer ersten schwangerschaftsassoziierten Thrombose gering.
Fazit
- Dran denken! Klinik!
- D-Dimere nur bei geringer Diagnosewahrscheinlichkeit bei Pat. ohne Begleiterkrankungen zum Ausschluss einer LE
- 1.Line Diagnostik mittels Spiral-CT
- Bei Kontraindikationen gegen KM EBUS erwägen
- Szintigraphie nur noch selten indiziert
- Risikostratifizierung über Troponin T und Echokardiographie